引言
在癌症治疗领域,自然杀伤细胞(Natural Killer cells,简称NK细胞)一直被誉为“免疫系统的利剑”。它们能够无须预警地识别并清除变异细胞,是肿瘤免疫应答的核心力量之一。
然而,临床观察却频频出现令人困惑的现象:即便患者体内检测到大量NK细胞,肿瘤却仍顽固不退,甚至迅速扩散。
问题出在哪?是NK细胞“名不副实”,还是肿瘤另有“驯化术”?一项发表于《Nature Communications》的研究终于给出了答案——进入肿瘤后的NK细胞,会在短短72小时内经历功能性“沉默”,由最具杀伤力的“突击队”转变为无声无力的“哨兵”。
它们不再杀敌、不再召唤增援,最终成为肿瘤免疫逃逸的“共谋者”。这项发现揭示了癌症治疗失败的关键机制,也为免疫疗法的优化指明了新方向。
01 72小时“沉默”进程,NK细胞是如何失去战斗力的?
研究团队采用了创新性的“时间标签”技术,对肿瘤内的NK细胞进行动态追踪。他们利用Kaede光敏标记小鼠模型,将新入肿瘤的NK细胞与已驻留细胞清晰区分,再通过单细胞RNA测序技术绘制出细胞状态演变全图。
这项分析揭示出令人震惊的变化:进入肿瘤不到24小时的NK细胞仍具活性,而72小时之后,大部分已陷入深度功能抑制状态。
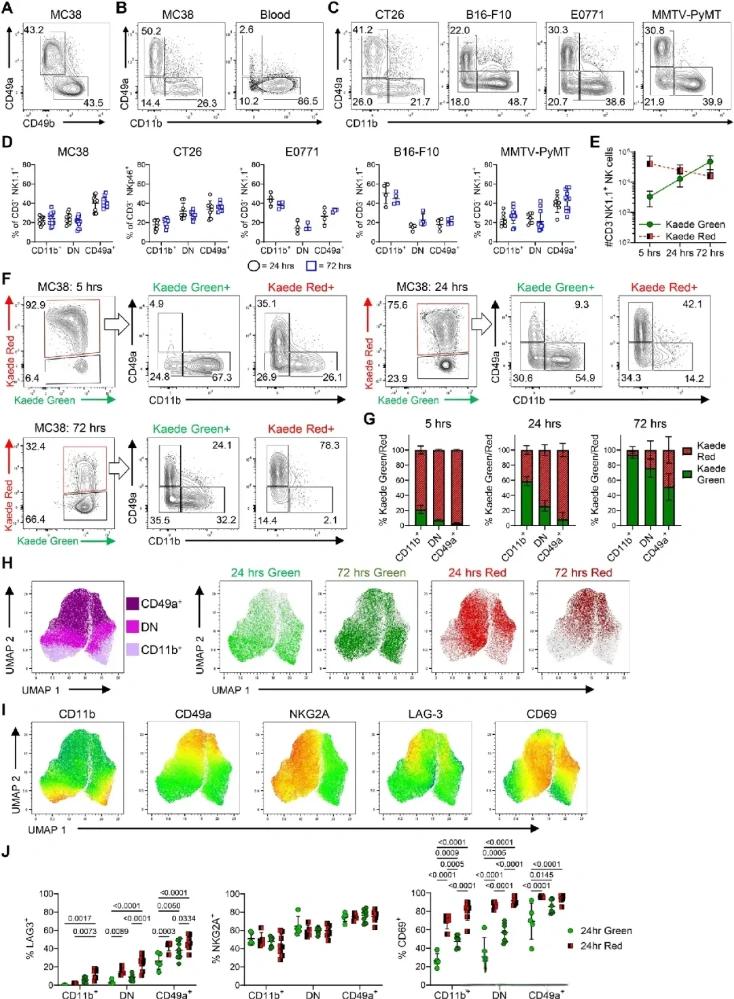
▲CD11b和CD49a的差异表达捕获NK细胞表型的时间变化
在这短短的时间内,NK细胞的转录组发生剧烈改变。其特有的杀伤性分子如Granzyme A、Perforin、IFN-γ等表达急剧下调;与此同时,免疫招募因子如CCL5、XCL1等也显著减少,意味着它们无法再有效激活树突状细胞和CD8+ T细胞,失去了对整个免疫系统的协同调动能力。
不仅如此,这些“沉默”的NK细胞还逐渐获得组织驻留表型,表达CD49a、CD69等标记物,呈现出类似ILC1的“非迁徙”特征。也就是说,它们不但沉默,还“扎根”在肿瘤中,成为肿瘤微环境的一部分,反而可能抑制其他免疫细胞的介入。
02 多个信号联手“驯化”NK,肿瘤微环境主导免疫失效
是什么力量驱使NK细胞“沉默”?研究团队进一步剖析肿瘤微环境中的信号通路,发现这一过程并非单一因子主导,而是TGF-β、PGE2、低氧(HIF-1α)等多个信号网络的联合压制所致。
首先,TGF-β是已知的“免疫刹车”因子,它能迅速抑制NK细胞的细胞毒性和趋化因子分泌。实验显示,单独用TGF-β刺激即可诱导CD49a表达、削弱CCL5释放。而当PGE2与TGF-β共同作用时,IFN-γ表达几乎完全沉默。
尽管这些信号在体外已显示强大影响力,但在体内实验证明,单一信号无法完全复制肿瘤中NK细胞的全面衰竭,说明这一“驯化”过程是多路径、深层级的免疫重编程。
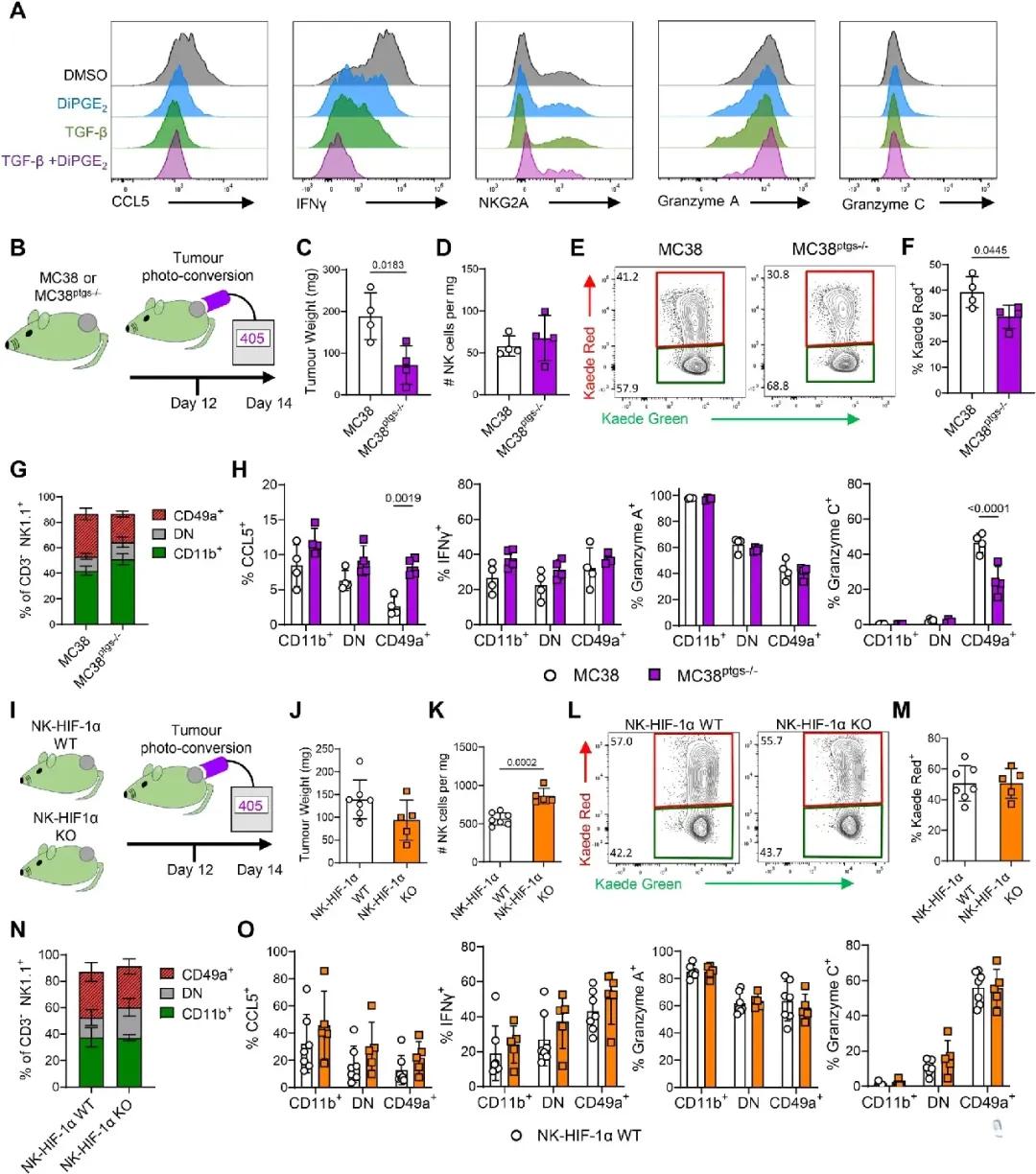
▲TME 中的多种机制驱动 cNK细胞转化为肿瘤保留的 CD49a+ 状态
低氧环境作为实体瘤的普遍特征,也被视为重要共谋。
研究团队利用NK细胞特异性HIF-1α敲除模型验证其作用,发现虽然对CD49a表达影响有限,但对细胞毒性因子仍存在显著抑制。这一切都表明,肿瘤通过一整套“训练机制”,将NK细胞从“杀手”改造成“门面”,彻底瓦解免疫封锁。
03 沉默不仅存在于鼠体,患者体内也上演同样悲剧
这项研究之所以备受瞩目,还因为它在人类癌症样本中得到了充分验证。研究团队分析了来自62位结直肠癌患者的单细胞转录组数据,共计3521个NK细胞。结果发现,与肿瘤边缘或正常组织中的NK细胞相比,肿瘤内部的NK细胞普遍呈现“沉默表型”。
其中,表达CD49a的NK细胞在晚期T4期和发生淋巴转移的患者中显著富集。这些细胞的细胞毒性基因(如PRF1、GZMB、GZMH)表达普遍下调,IFN-γ与CD16表达也明显减少,呈现出与小鼠模型中一致的“低活性+高驻留”双重状态。
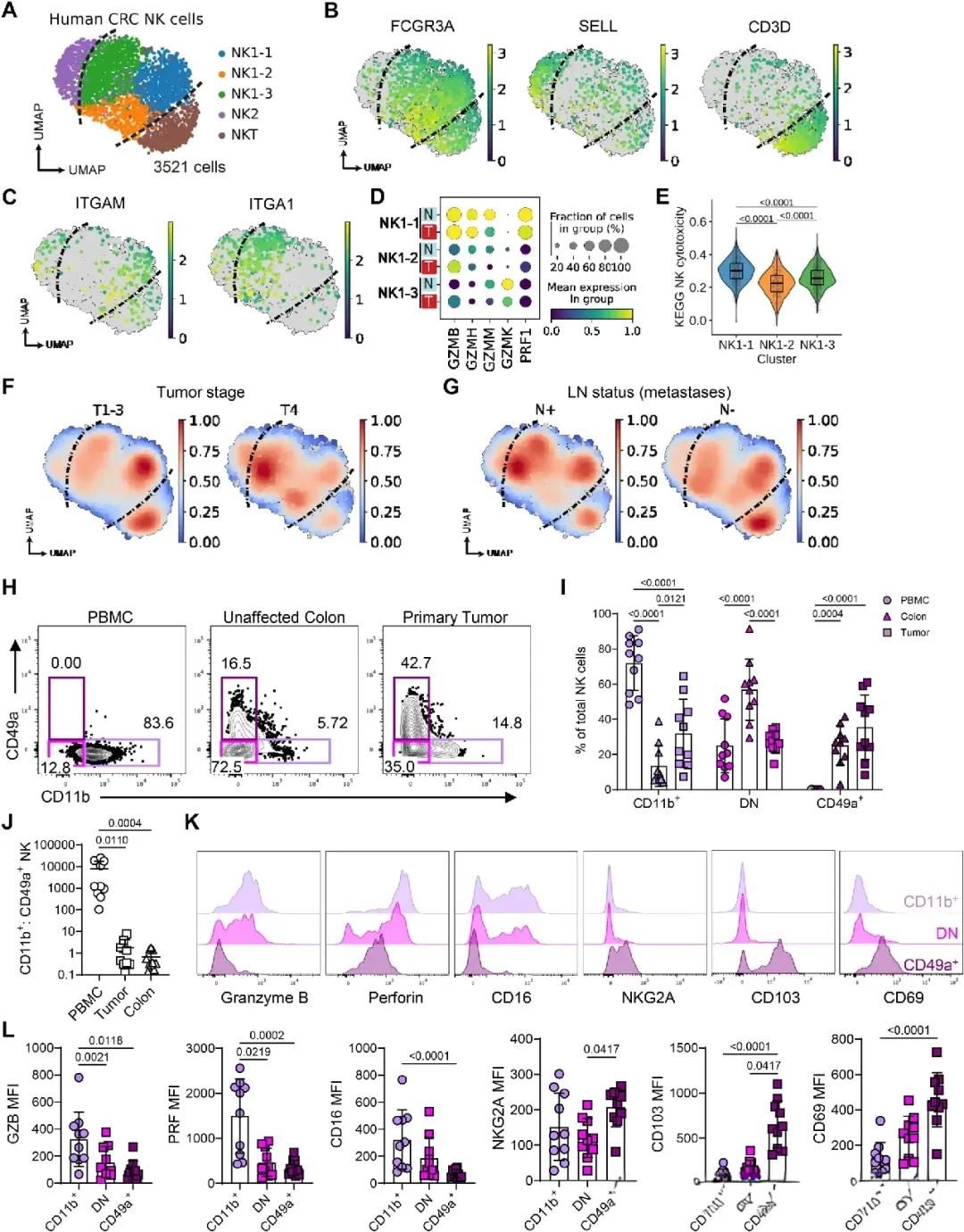
▲人CRC中的NK细胞显示效应功能丧失
更进一步,流式细胞术验证显示,肿瘤内的CD49a+ NK细胞与外周血中的CD11b+ NK细胞相比,明显缺乏Granzyme B与Perforin表达,同时高表达抑制性受体如NKG2A、LAG-3,表明它们不但“沉默”,还可能积极干扰免疫激活通路。这种“功能性缺席”或许正是众多癌症患者免疫疗效不佳的根源。
04 激活沉睡的NK,IL-15疗法带来突破曙光
面对被肿瘤“驯化”的NK细胞,有没有办法重新唤醒它们?研究团队尝试使用IL-15:IL-15Ra复合物增强NK细胞功能,这种形式比单独使用IL-15更具生物活性。
结果显示,在多种小鼠肿瘤模型中,IL-15强化信号不仅显著延缓肿瘤生长,还逆转了NK细胞的沉默状态。
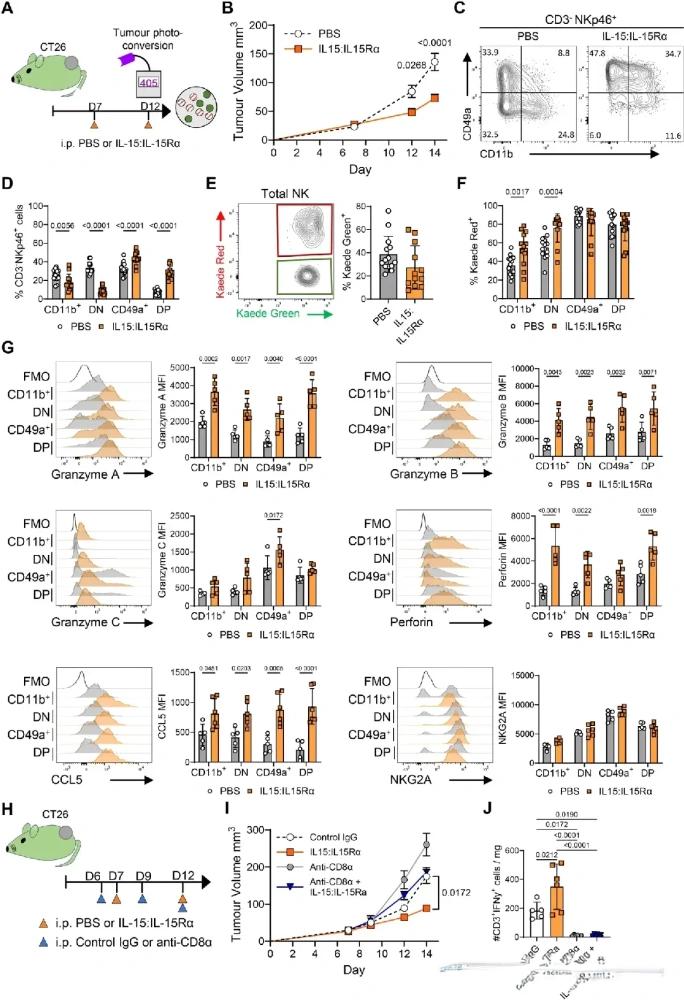
▲IL15:IL15Rα 复合物的给药可增强肿瘤控制,并形成功能增强的 CD49 + CD11b + 瘤内 NK 细胞
接受IL-15:IL-15Ra治疗的肿瘤中,NK细胞虽然依然表达CD49a,但同时保留了高水平的Granzyme A/B、Perforin、CCL5等杀伤及招募因子,形成了一种前所未见的“双能表型”:既能驻留于肿瘤,又能积极战斗。研究人员将其称为“混合型高效应NK细胞”,这或许正是未来细胞疗法的理想模板。
更重要的是,当去除CD8+ T细胞时,这种经IL-15强化后的NK细胞仍能独立控制肿瘤生长,证明其具有真正的治疗效应。这也意味着,即便在T细胞功能受限的患者中,激活NK细胞仍有望成为“第二战线”。
05 一场免疫大戏的关键主角,终于被看到
这项《Nature Communications》的研究,首次从动态、时间、机制和干预四个维度,全面揭示了NK细胞在肿瘤免疫应答中的核心作用。
它告诉我们:免疫失败,并非“无兵可派”,而是“兵临城下却已被缴械”。NK细胞不是无能,而是被肿瘤环境精准“封印”。
而破解之道,也正在浮现。IL-15等免疫增强路径,为重新激活这些沉睡杀手提供了坚实证据。在未来的癌症免疫治疗中,NK细胞不应只是“辅助角色”,而应是战略性起点。正视并保护它的功能,或许将是重塑疗效、终结“假死逃逸”的关键一步。
声明
1.本文系转载。
2.本文旨在分享科普知识,进行学术交流,或传递行业前沿进展,不作为官方立场,不构成任何价值判断,不作为相关医疗指导或用药建议,无任何广告目的,非进行产品贩卖,仅供读者参考。
3.本账号转载的图文视频等内容若涉及版权等问题,请联系我们及时处理删除。
|
上一条:修复身材的黄金组合=干细胞+免疫细胞
下一条:免疫细胞回输体内1小时、1天、1周、1个月、1年的变化 |
返回列表 |